Laboratoire
Évaluation de l'identification de la toxicité (TIE)
fév. 14 2020
L’évaluation de l’identification de la toxicité (TIE) est une étude propre au site permettant d’isoler, d’identifier et de confirmer les agents responsables de la toxicité dans un effluent. Bureau Veritas réalise la TIE selon les procédures publiées par l’Environmental Protection Agency (EPA) des États-Unis. L’évaluation de la réduction de la toxicité (TRE) permet d’identifier les constituants toxiques qui peuvent être éliminés ou réduits dans les effluents industriels afin d’atténuer les problèmes de toxicité. Une TIE doit généralement être effectuée avant une TRE.
La TIE utilise les réponses des organismes testés pour détecter la présence de substances toxiques avant et après que les échantillons soient soumis à une série de traitements physiques et chimiques. Cela permet d’isoler et ensuite d’identifier les substances toxiques responsables. L’EPA [1],[2],[3] fournit les détails de cette approche, y compris les procédures spéciales pour les TIE et les TRE des eaux usées municipales [4].
La toxicité peut être déterminée en utilisant des organismes aquatiques d’eau douce, qui comprennent le plus souvent : la croissance des algues, Pseudokirschneriella subcapitata, un test bactérien, Microtox®, Vibrio fischeri, la survie des macroinvertébrés, Daphnia magna, un test biologique sur les poissons, la tête-de-boule, Pimephales promelas ou la truite arc-en-ciel Oncorhynchus mykiss. Cet ensemble de tests aquatiques mesure la toxicité à court terme, ou létalité aiguë, et est recommandé par Environnement Canada pour l’évaluation de la qualité de l’eau. [5].
Bureau Veritas peut effectuer des TIE pour les environnements récepteurs estuariens ou marins en utilisant les organismes de test suivants : croissance d’algues Champia parvula, test bactérien, Microtox®, Vibrio fischeri, fertilisation des échinodermes, Dendraster excentricus et capucette barrée Atherinops affinis. Ces méthodes sont décrites plus en détail dans le document USEPA Marine Toxicity Identification Evaluation Guidance [6].
Des méthodes spéciales peuvent également être utilisées pour les sédiments d’eau douce et marins en utilisant des organismes invertébrés appropriés de ces sédiments. Hyalella azteca et Chironomus tentans peuvent être utilisés pour les sédiments d’eau douce. Les tests d’échinodermes ou d’embryons de bivalves et les espèces d’amphipodes marins et estuariens sont couramment utilisés pour les sédiments marins. Les tests biologiques Microtox® en phase solide peuvent être utilisés pour évaluer la toxicité de Vibrio fischeri pour les sédiments d’eau douce et d’eau de mer. De plus, des tests spéciaux peuvent être effectués en utilisant la zéolite [7] ou Ulva lactuca [8] pour identifier la toxicité de l’ammoniac dans les sédiments d’eau douce et marins respectivement.
Méthodologie de TIE
La méthodologie de base de la phase I de la TIE comprend généralement :
- évaluation initiale de la toxicité
- test d’ajustement du pH et filtration
- test d’ajustement du pH et aération
- test d’ajustement du pH et extraction en phase solide (SPE)
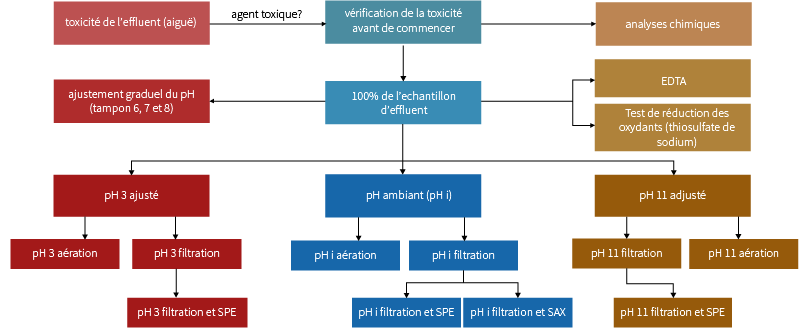
Ces traitements TIE sont résumés dans la figure 1.
Figure 1: Traitements TIE
On constate souvent que la filtration avec ajustement du pH, l’aération et les tests SPE peuvent être utilisés pour identifier la plupart des substances toxiques organiques. Les tests de réduction des oxydants et de chélation d’EDTA sont importants lorsque des composés inorganiques ou des métaux sont impliqués comme agents de toxicité. Chacun de ces tests est décrit ci-dessous.
Évaluation initiale de la toxicité
Le but de ce test est de déterminer si l’échantillon est toxique. Le test est effectué sur les échantillons dès leur réception et la toxicité des échantillons est testée à l’aide des quatre tests biologiques décrits ci-dessous :
- Microtox®, test bactérien, Vibrio fischeri, test de 15 minutes
- survie des macroinvertébrés, Daphnia magna, test de 48 heures
- croissance des algues, Pseudokirschneriella subcapitata, test de 72 heures
- test biologique sur les poissons, tête-de-boule, Pimephales promelas, test de 48 heures
Les données de toxicité (CI50 et CL50) sont obtenues et converties en unités toxiques. Les données sont ensuite examinées et l’espèce la plus sensible est identifiée. Cette espèce est ensuite utilisée pour les tests de toxicité ultérieurs.
Test d’ajustement du pH et filtration
Ce test fournit des informations sur la toxicité associée aux matériaux filtrables. Les échantillons sont filtrés après ajustement du pH (pH 3, 11 et ambiant) et le filtrat résultant est ajusté au pH ambiant si nécessaire et testé pour sa toxicité. En filtrant des aliquotes d’échantillons à pH ajusté, les composés qui se trouvent généralement en solution à un pH non ajusté (c’est-à-dire le pH ambiant) sont rendus insolubles ou sont associés à des particules à des pH plus extrêmes et sont éliminés pendant le processus de filtration. Par exemple, les métaux toxiques peuvent former des complexes insolubles à un pH plus élevé et sont ensuite éliminés lors de la filtration, ce qui rend l’échantillon moins toxique. L’ajustement du pH est effectué en ajoutant un acide dilué (0,1 N HCl) et une base diluée (0,1 N NaOH). En combinaison, ils forment le sel (NaCl), qui peut être toxique pour les organismes d’eau douce et les macroinvertébrés. Afin de contrôler la toxicité introduite artificiellement, telle que la production de sel lors des ajouts d’acides et de bases, un échantillon de contrôle constitué d’eau nutritive pour essais biologiques est analysé en parallèle avec les échantillons. Toute toxicité observée pour l’échantillon de contrôle est ensuite appliquée aux résultats obtenus pour les échantillons.
Test d’ajustement du pH et aération
Les échantillons toxiques sont aérés pendant une heure après l’ajustement du pH (pH 3, 11 et ambiant). Après le barbotage, les échantillons sont ramenés au pH ambiant si nécessaire et la toxicité est testée. L’objectif est de déterminer si des constituants volatils sont responsables de la toxicité observée. Un ajustement du pH est nécessaire car certains composés toxiques se présentent sous différentes formes en fonction du pH. Par exemple, les acides organiques de faible poids moléculaire seront efficacement éliminés par barbotage à pH acide (c’est-à-dire pH 3), cependant, ces composés peuvent être dissociés (ou former des sels) à un pH plus élevé et ne seront donc pas purgés à un pH plus élevé.
Test d’ajustement du pH et extraction en phase solide
Le test d’ajustement du pH et l’extraction en phase solide sont conçus pour déterminer l’étendue de la toxicité causée par les composés organiques et les chélates métalliques qui sont efficacement éliminés par l’extraction en phase solide. L’échantillon est passé à travers une petite colonne de silice greffée d’octadécyle (-SiC18H37) après ajustement du pH (pH 3, 11 et ambiant). L’effluent qui résulte de la colonne est collecté, ajusté au pH ambiant si nécessaire et soumis à des tests de toxicité. Si une toxicité importante est éliminée par l’extraction en phase solide, on suppose alors que les produits chimiques toxiques sont contenus dans les cartouches d’extraction en phase solide.
Comme ces cartouches contiennent probablement de nombreux composés, il est souhaitable d’effectuer une séparation chromatographique suivie de tests de toxicité afin d’isoler les produits chimiques toxiques des produits chimiques non toxiques. Cette opération est réalisée par chromatographie en phase inverse, c’est-à-dire que les cartouches sont dépouillées avec de petites quantités (4 ml) de solutions eau-méthanol, notamment :
- 75 % d’eau : 25 % de méthanol
- 50 % d’eau : 50 % de méthanol
- 25 % d’eau : 75 % de méthanol
- 100 % de méthanol
Dans la chromatographie en phase inverse, les produits chimiques sont absorbés sur la surface de la silice greffée d’octadécyle. La séparation des produits chimiques est basée sur la polarité ou la solubilité dans l’eau. Les composés hautement polaires tels que les alcools, les acides carboxyliques, etc. peuvent être éliminés en les éluant avec de petites quantités de méthanol dans l’eau (par exemple 75 % d’eau : 25 % de méthanol). Les composés qui ne sont pas polaires ou hydrophobes nécessitent du méthanol pur pour les éliminer de la colonne. Par exemple, les hydrocarbures tels que les hydrocarbures aromatiques polycycliques (HAP) nécessitent du méthanol pur afin de les extraire de la colonne. Les composés de polarité intermédiaire, tels que les phénols, les amines, les cétones, etc. nécessitent des concentrations de méthanol de 50 à 75 % pour être éliminés de la silice greffée d’octadécyle.
Une aliquote de chacun des éluats de la colonne est diluée avec de l’eau de contrôle et soumise à des tests de toxicité. La partie aliquote restante pour chacun des éluats de la colonne est archivée en vue d’une éventuelle analyse chimique. La dilution avec de l’eau de contrôle est nécessaire pour éliminer les effets toxiques du méthanol. Cette dilution ne compromet pas les données de toxicité. Par exemple, si un échantillon de 1000 ml est soumis à une extraction en phase solide et que la cartouche en phase solide est éluée avec 4 ml d’eau-méthanol, l’effet net est une concentration 250 fois supérieure. La dilution de 3 ml de l’éluat de la colonne avec 200 ml d’eau nutritive donne une concentration nette de 3,75 fois l’échantillon. En d’autres termes, les effets toxiques du méthanol peuvent être atténués sans diluer les effets toxiques des produits chimiques qui ont causé la toxicité dans l’échantillon.
Test de réduction des oxydants
Ce test est conçu pour déterminer le rôle des oxydants tels que le chlore dans la toxicité. Ce test implique l’ajout de thiosulfate de sodium (Na2S2O3) aux échantillons d’effluents qui neutralisera la toxicité du chlore et d’autres composés désinfectants tels que l’ozone et le dioxyde de chlore. Bien que conçu à l’origine pour déterminer le rôle des oxydants dans la toxicité, le thiosulfate de sodium peut également se complexifier avec des métaux tels que le cadmium, le cuivre, l’argent et le mercure.
Test de chélation de l’EDTA
Le test de chélation de l’EDTA est utilisé pour déterminer l’étendue de la toxicité causée par les métaux cationiques. Des quantités croissantes d’un agent chélatant (EDTA, ligand éthylènediaminetétraacétate) sont ajoutées aux aliquotes de l’échantillon d’effluent. L’EDTA est un agent chélatant puissant et formera des complexes relativement non toxiques avec de nombreux métaux. Le succès de ce traitement dépend de plusieurs facteurs, notamment : le pH de la solution, le type et la spéciation des métaux, la présence d’autres ligands en solution, et l’affinité de liaison de l’EDTA avec le métal qui provoque la toxicité. Les cations les plus typiquement chélatés par l’EDTA sont l’aluminium, le baryum, le cadmium, le cobalt, le cuivre, le fer, le plomb, le manganèse, le nickel, le strontium et le zinc. Les séléniures, les chromates et les hydrochromates ne sont pas chélatés par l’EDTA, tandis que l’arsenic et le mercure forment de faibles chélates avec l’EDTA.
Analyse inorganique complète
Les analyses inorganiques requises comprennent : les métaux dissous, notamment l’arsenic, le sélénium, le mercure et l’antimoine. Sont également inclus les paramètres habituels de l’eau tels que le pH, la conductivité électrique, le calcium, le magnésium, le sodium, le potassium, le fer, le sulfate, le chlorure, le nitrate et le nitrite, l’alcalinité totale, la dureté, l’ammoniac, l’azote total Kjeldahl, le carbone organique total, le sulfure d’hydrogène et les solides dissous. Des analyses inorganiques sont nécessaires pour déterminer si des produits chimiques tels que les métaux, l’ammoniac ou le sulfure d’hydrogène, le sel, etc. sont responsables de la toxicité observée.
Analyses organiques des fractions toxiques
Pour cette étude particulière, l’extraction en phase solide peut être efficace pour éliminer la toxicité des échantillons. De plus, les substances toxiques peuvent être isolées efficacement en éluant les cartouches d’extraction en phase solide avec de l’eau et des mélanges de méthanol. Certains mélanges eau-méthanol peuvent s’avérer efficaces pour éliminer les substances toxiques des cartouches d’extraction en phase solide. Ces mélanges seront analysés afin d’identifier les composés organiques responsables de la toxicité observée.
L’éluat archivé (mélange eau-méthanol, 1,0 ml) qui s’avère toxique est traité comme suit :
- 200 μl retenus pour l’analyse par chromatographie liquide couplée à la spectrométrie de masse (LC/MS)
- 800 μl échangés en chloroforme
- 200 μl de l’extrait de chloroforme analysés par chromatographie en phase gazeuse couplée à la spectrométrie de masse (GC/MS)
- 200 μl de l’extrait de chloroforme dérivatisés avec de l’anhydride acétique et analysés par GC/MS
- 200 μl de l’extrait de chloroforme dérivatisés avec du diazométhane et analysés par GC/MS
- Les données obtenues à partir des trois analyses GC/MS ainsi que les données obtenues à partir de l’analyse LC/MS sont interprétées, analysées et une liste de substances toxiques potentielles est élaborée.
Dans le cas où le test d’ajustement du pH et d’aération entraîne une réduction significative de la toxicité, des techniques telles que la purge et la chromatographie en phase gazeuse à système de piégeage (Purge and Trap) couplée à la spectrométrie de masse sont alors appliquées pour identifier les substances toxiques. Cette technique est appliquée aux composés dont la pression de vapeur est élevée et qui peuvent être éliminés efficacement par barbotage.
Méthodes spéciales pour les sédiments d’eau douce et marins
Identification de la toxicité de l’ammoniac dans les sédiments d’eau douce
La zéolite a été utilisée pour identifier la toxicité de l’ammoniac dans les sédiments d’eau douce. Il a été démontré que l’ajout de zéolite granulée aux sédiments réduit la toxicité de l’ammoniac pour les invertébrés d’eau douce [7]. La zéolite s’est avérée non toxique pour les organismes testés et peut également être utilisée pour traiter des échantillons d’eau douce et d’effluents afin d’éliminer l’ammoniac.
Identification de la toxicité de l’ammoniac dans les sédiments marins
L’Ulva lactuca peut être utilisée si une toxicité dépendante du pH est constatée dans les résultats du test d’ajustement du pH. Il s’agit d’un nouvel ajout intéressant au protocole de TIE pour l’eau et les sédiments marins. L’Ulva lactuca (Laitue de mer) a été utilisée récemment pour éliminer la toxicité de l’ammoniac des échantillons de sédiments et d’eau marins à des fins d’identification de la toxicité [8]. L’Ulva lactuca a la capacité d’absorber, de stocker et d’utiliser de grandes quantités d’ammoniac. Cette Laitue de mer peut également absorber de petites quantités de métaux présents et peut absorber des composés organiques tels que les pesticides et les HAP. Elle peut être utilisée efficacement en conjonction avec les autres procédures de TIE pour identifier les constituants toxiques dans les échantillons de sédiments ou d’eau de mer. L’Ulva lactuca peut être obtenue commercialement en Californie pour les besoins de ces tests. Des morceaux de cinq grammes d’Ulva peuvent être incorporés dans des contenants de test biologique avec les organismes de test. Elle peut être une alternative utile aux tests d’ajustement du pH et d’aération.
Méthodes de traitement personnalisées
Bureau Veritas a développé et adapté des méthodes de traitement sur mesure pour identifier des composés suspects spécifiques dans un échantillon d’effluent. Par exemple, nous avons mis au point une méthode pour éliminer sélectivement les solides totaux en suspension (TSS) des effluents miniers afin d’examiner leur rôle dans la toxicité. Nous avons également utilisé des résines sélectives aux ions pour examiner le rôle de la toxicité du bore dans les effluents des scories. De même, des techniques d’ultrafiltration et d’électrophorèse ont été appliquées pour examiner le rôle des molécules organiques à haut poids moléculaire dans les échantillons d’effluents de pâte et papier.
Bureau Veritas est le seul à pouvoir fournir des tests de traitement personnalisés. Nous disposons d’un ensemble d’experts dans les domaines de la toxicologie environnementale et aquatique, de la chimie analytique et des procédés, du drainage minier acide (AMD) et du drainage rocheux acide (ARD), de la métallurgie extractive, du biolixiviat et de la technologie de traitement des eaux usées, le tout dans un seul laboratoire.
L’expertise de Bureau Veritas
La nature multidisciplinaire de notre entreprise comprend une équipe de scientifiques ayant de nombreuses années d’expérience et d’expertise pour fournir des solutions pour l’industrie des pâtes et papiers, l’exploitation minière, le traitement des eaux usées et d’autres effluents industriels.
Bureau Veritas fournit des services de TIE et de TRE aux clients qui ont besoin de déterminer les composants toxiques dans un mélange chimique, tel qu’un effluent. Nous disposons de trois laboratoires d’écotoxicologie situés en Alberta, en Colombie-Britannique et au Québec.
Références
[1] USEPA (1991). Methods for Aquatic Toxicity Identification Evaluations: Phase I Toxicity Characterisation Procedures. EPA/600/6‐91/003.
[2] USEPA (1993). Methods for Aquatic Toxicity Identification Evaluations: Phase II Toxicity Identification Procedures for Samples Exhibiting Acute and Chronic Toxicity. EPA‐600/R‐92/080.
[3] USEPA (1993). Methods for Aquatic Toxicity Identification Evaluations: Phase III Toxicity Confirmation Procedures for Samples Exhibiting Acute and Chronic Toxicity. EPA‐600/R‐92/081.
[4] USEPA (1999). Toxicity Reduction Evaluation Guidance for Municipal Wastewater Treatment Plants. EPA 833‐B‐99‐002.
[5] Environnement Canada, Programme national d'assainissement des sites contaminés (1992). Examen des biotests effectués sur des organismes entiers pour l'évaluation de la qualité des sols, des sédiments et des eaux douces au Canada. Disponible auprès d'Environnement Canada, Programme national d'assainissement des sites contaminés, Ottawa, Ontario, 294 pp.
[6] USEPA (1996) Marine Toxicity Identification Evaluation (TIE): Phase I Guidance Document. EPA/600/R‐96/054.
[7] Besser, J.M., C.G. Ingersoll, E.N. Leonard and D.R. Mount (1998). Effect of zeolite on toxicity of ammonia in freshwater sediments: Implications for toxicity identification evaluation procedures. Environmental Toxicology and Chemistry: 17, 11, 2310‐2317.
[8] Ho, K.T., A. Kuhn, M.C. Pelletier, R.M. Burgess, and A. Helmstetter (1999). Use of Ulva lactuca to distinguish pH‐dependent toxicants in marine waters and sediments. Environmental Toxicology and Chemistry: 18, 2, 207‐212.