Laboratoire
Étude des sels de voirie
sep. 17 2019
Utilisation des rapports Cl-/Br- et d’autres indicateurs pour évaluer et différencier les sels de voirie et pour comprendre les répercussions sur les eaux souterraines
Partout au Canada, les municipalités utilisent des sels de voirie à base de chlorure de sodium (NaCl), essentiellement du « sel gemme » ou halite, pour déglacer les chaussées à bon prix. Parallèlement, le sodium (Na+) et le chlorure (Cl-), ainsi que la conductivité électrique, le rapport d’absorption du sodium (RAS), la salinité et la sodicité (qui peuvent être fortement influencées par les concentrations de Na+ et de Cl-) sont contrôlés et réglementés par plusieurs autorités en tant que sources d’inquiétudes pour l’environnement.
De par leur stabilité et leur caractère persistant dans les aquifères, le bromure (Br-), le chlorure (Cl-) et l’iodure (I-) se sont avérés être de précieux traceurs pour étudier le mouvement des eaux souterraines. Plus récemment, l’évaluation des rapports de concentration de ces ions, en particulier le chlorure et le bromure (Cl-/Br-), a également servi à étudier les circuits d’eau souterraine potable et à déterminer l’origine et l’évolution des eaux salées et des saumures de surface et de subsurface.
Fonctionnement des sels de voirie
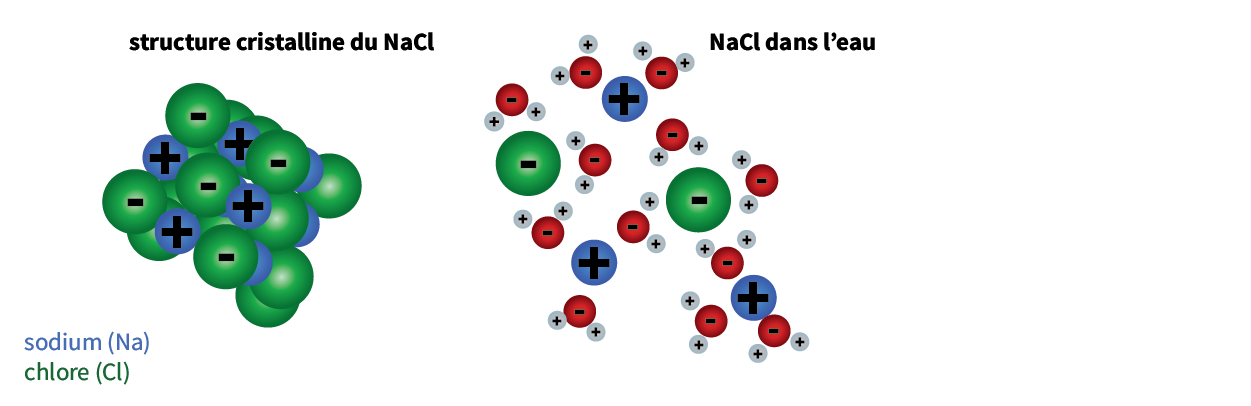
L’eau gèle à 0 °C (32 °F). À cette température, les molécules d’eau s’organisent en structures cristallines et se transforment en glace, comme illustré à la figure 1. Le sel abaisse le point de congélation de l’eau en interrompant le processus de cristallisation. Les sels de voirie se décomposent en sodium et en chlorure dans l’eau. Ces derniers se déplacent alors dans l’eau pour occuper de l’espace dans la structure de ses molécules. Cela a pour effet d’écarter les molécules d’eau et d’interrompre le processus de formation de la glace, en abaissant ainsi son point de congélation.
Bien que cette méthode soit efficace pour empêcher la formation de glace, elle comporte une limite qui lui est inhérente. À des températures inférieures à -18 °C, la capacité du sel (NaCl) à empêcher la formation de glace diminue.
Figure 1. Procédé par lequel les sels de voirie empêchent l’eau de geler
Historique
Du chlorure de sodium granuleux a été utilisé pour la première fois à titre expérimental pour dégeler les chaussées en 1938. Depuis, l’utilisation de chlorure de sodium et d’autres agents déglaçants s’est généralisée.
Chaque année, environ 5 000 000 de tonnes de sel gemme sont utilisées au Canada uniquement sur les routes. Les villes de Toronto et de Calgary en utilisent en moyenne respectivement près de 140 000 et 35 000 tonnes.
Répercussions sur l’environnement
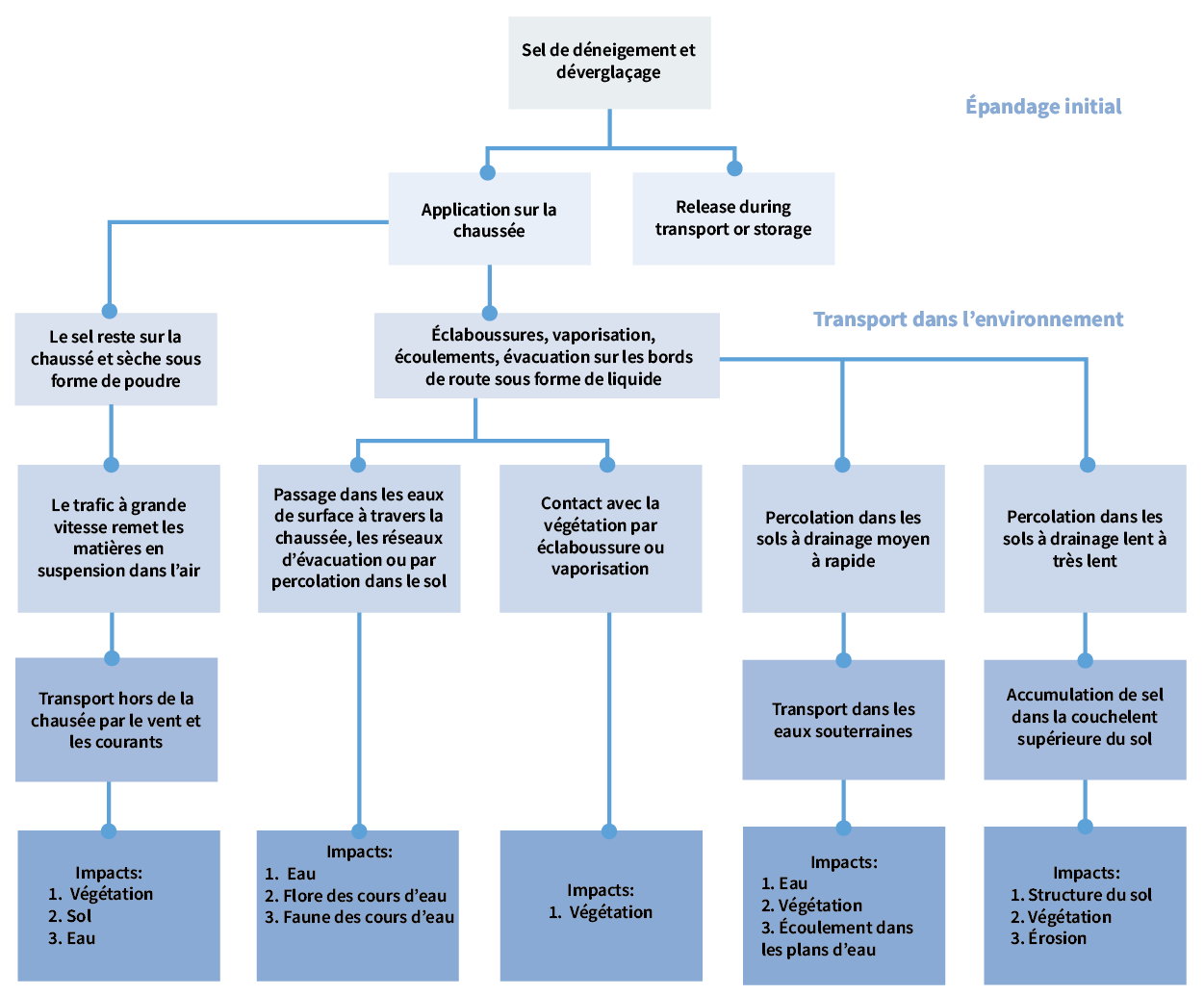
En général, le NaCl pénètre dans l’environnement par ruissellement des eaux de fonte des neiges et des stations d’épuration, celles-ci n’étant normalement pas équipées pour retirer le NaCl en cours de traitement. Les autres voies de pénétration potentielles sont illustrées à la figure 2.
Figure 2. Voies de pénétration dans l’environnement et répercussions des sels de voirie [1]
Règlementation
Même s’ils ne sont pas réglementés sous forme de sel (NaCl), les ions individuels le sont par la plupart des autorités, comme indiqué dans le tableau 1 ci-dessous. Le NaCl est également contrôlé par des mesures indirectes comme celles de la salinité, de la conductivité électrique (CE) et de la sodicité, à partir de mesures du rapport d’absorption du sodium [2] (RAS).
Tableau 1. Règlementation relative au sodium et au chlorure au Canada
| PARAMÈTRES | C.-B. | Alb. | Sask. | Man. | Ont. | CCME |
|---|---|---|---|---|---|---|
| Eau potable | ||||||
| Sodium (mg/L) | 200 | 200 | 200 | 200 | NV | 200 |
| Chlorure (mg/L) | 250 | 250 | 250 | 250 | NV | 250 |
| Eaux souterraines | ||||||
| Sodium (mg/L) | NV | 200 | 200 | 200 | 490 | NV |
| Chlorure (mg/L) | 100 | 100 | 250 | 250 | 790 | NV |
| Eaux de surface (protection de la vie aquatique dans l'eau douce) | ||||||
| Sodium (mg/L) | NV | 200 | NV | NV | NV | NV |
| Chlorure (mg/L) | 1 500 | 100 | 120 | NV | NV | 120 |
| Sol | ||||||
| Sodium (ug/g) | 150 | NV | NV | NV | NV | NV |
| Chlorure (ug/g) | 100 | NV | NV | NV | NV | NV |
Applications analytiques du chlorure (Cl-), du bromure (Br-) et de l’iodure (I-) contenus dans les sels de voirie
Le chlorure, le bromure et l’iodure sont présents dans le sel. Le chlorure est généralement de 40 à 8 000 fois plus abondant dans la nature que le bromure. Les méthodes d’analyse les plus couramment utilisées pour déterminer les quantités de Cl-, de Br- et d’I- sont : la chromatographie par échange d’ions, la colorimétrie et l’analyse par activation neutronique (AAN). Cependant, les Laboratoires Bureau Veritas disposent désormais de méthodes pour déterminer ces ions à l’état de trace, à l’aide de la spectrométrie de masse à plasma à couplage inductif (ICP-MS). Le tableau 2 (ci-dessous) liste les méthodes d’analyse disponibles et les limites de détection représentatives.
Tableau 2. Méthodes d'analyse et limites de détection types du Cl-, Br- et I-
| PARAMÈTRES | AAN | CHROMATOGRAPHIE PAR ÉCHANGE D’IONS | ICP/MS |
|---|---|---|---|
| Iodure | 2 ppb | ||
| Bromure | 20 ppb | 50 ppb | |
| Chlorure | niveau ~1 ppm | 10 ppb | 5 ppm |
Une étude interne préliminaire sur différents produits salins du commerce a montré des différences dans les quantités relatives (mesurées par ICP-MS) de Cl-, de Br- et d’I-, suivant l’origine du sel (voir tableau 3).
Il a également été démontré [3] que les rapports entre ces ions peuvent permettre de différencier les eaux souterraines pures des sources d’eaux usées et autres sources anthropiques, comprenant notamment les sels de voirie.
Tableau 3. Rapports Cl-/Br- et Cl-/I- de six produits salins du commerce
| PARAMÈTRES | SEL DE VOIRIE « SEL BLEU » | SEL DE VOIRIE « GÉNÉRIQUE » | SEL DE MER DU COMMERCE | SEL DE TABLE DU COMMERCE | SEL GEMME DE L’HIMALAYA (ROSE) | GROS SEL DU COMMERCE |
|---|---|---|---|---|---|---|
| Iodure | ND | 0.3 | 30 | 70 | ND | ND |
| Bromure | 1 200 | 1 600 | 50 | 310 | 60 | 48 |
| Chlorure | 510 000 | 470 000 | 260 000 | 540 000 | 520 000 | 490 000 |
| Cl-/Br- | 430 | 290 | 5 200 | 1 700 | 8 700 | 10 000 |
| Cl-/I- | 5,1 x 108 | 1,6 x 106 | 8 700 | 7 700 | 5,2 x 108 | 4,9 x 108 |
Remarque : En l’absence d’I- au-dessus de la limite de détection de 2 ppb, on a utilisé ½ de la limite de détection pour calculer le rapport Cl-/I-.
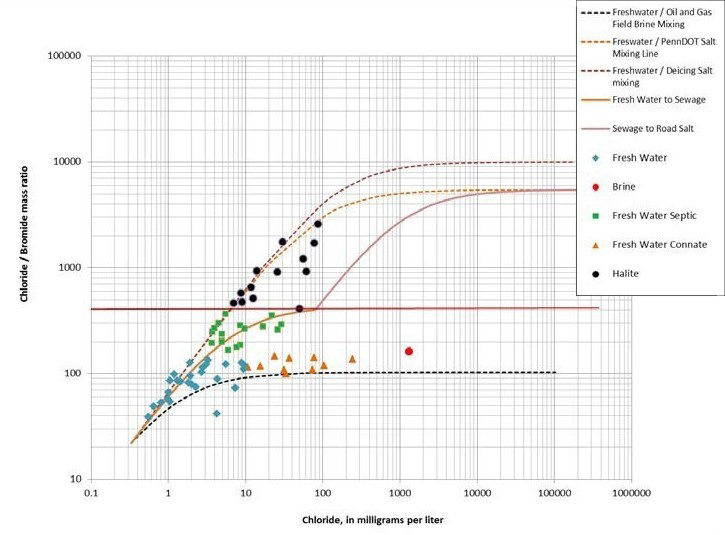
Figure 3. Rapports Cl-/Br- et taux de Cl- pour différencier cinq types d’eau : eau douce, saumure, eau douce septique, eau douce connée et halite. [4]
Les laboratoires Bureau Veritas ont également démontré, par l’analyse d’échantillons « réels », la capacité de différencier diverses sources d’effets du sel sur les eaux souterraines.
Références
[1] National Cooperative Highway Research Program Report 577: Guidelines for the Selection of Snow and Ice Control Materials to Mitigate Environmental Impacts
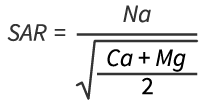
[2] Le rapport d’absorption du sodium (RAS) mesure la proportion de sodium par rapport au calcium et au magnésium dans une solution du sol:
[3] Katz, B.G. et coll. : « Using Cl/Br ratios and other indicators to assess potential impacts on groundwater quality from septic systems: A review and examples from principal aquifers in the United States ». Journal of Hydrology, vol. 397, 2011, p. 151-166.
[4] W Naily et Sudaryanto 2018 IOP Conf. Ser.: Earth Environ. Sci. 118 012020